
L'apoptose est un processus physiologique normal, dont le programme est caractérisé par certaines caractéristiques morphologiques, notamment la perte de l'asymétrie et de l'attachement de la membrane plasmique, la condensation du cytoplasme et du noyau, et le clivage internucléosomique de l'ADN. La coloration de l'annexe V de la FITC précède la perte d'intégrité de la membrane qui accompagne les dernières étapes de la mort cellulaire résultant de processus apoptotique ou nécrotique. Par conséquent, la coloration à l'Annexine V FITC est généralement utilisée en conjonction avec un colorant vital tel que l'iodure de propidium (PI) pour identifier les cellules apoptotiques précoces (PI négatif, Annexine V FITC positif). Les cellules viables dont les membranes sont intactes excluent l'IP, alors que les membranes des cellules mortes ou endommagées sont perméables à l'IP. Laissez-nous déterminer si le traitement avec votre molécule entraîne l'apoptose dans vos échantillons et recevez des données concernant le pourcentage de cellules vivantes, apoptotiques et mortes dans chaque échantillon. Notre équipe de cytométrie en flux peut effectuer des tests d'apoptose sur de multiples types d'échantillons tels que des cellules cultivées, du sang ou des tissus, et, si vous le souhaitez, analyser des sous-ensembles spécifiques de cellules dans chaque échantillon.
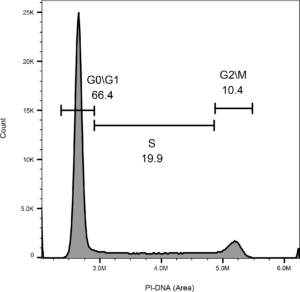
Lors de la coloration de l'ADN d'une cellule avec un agent fluorescent se liant à l'ADN, tel que l'iodure de propidium (IP), la quantité relative d'ADN dans la cellule peut être mesurée par cytométrie en flux et l'étape du cycle cellulaire peut donc être élucidée. Pendant la phase G0 ou G1, une cellule contient 46 chromatides ; pendant la phase S, les chromosomes se dupliquent, et à la fin de la phase S, G2, ou phase M, il y a 92 chromatides. Cette méthode permet de confirmer les effets des inhibiteurs de points de contrôle du cycle cellulaire. Nos experts en cytométrie en flux sont en mesure de confirmer les effets des inhibiteurs des points de contrôle du cycle cellulaire avec la méthode mentionnée ci-dessus, ainsi que de déterminer le pourcentage de cellules à différents stades du cycle cellulaire dans des échantillons tels que les cellules cultivées, le sang et les tissus.

Nous proposons également la cytométrie en flux phospho-flow, qui est un outil précieux pour l'étude de nouveaux médicaments et de leurs effets sur l'activation des voies de signalisation cellulaire in vitro ; ainsi que la possibilité de mesurer les effets des médicaments in vivo en multiplexant la technique avec des marqueurs de surface cellulaire utilisés pour l'immunophénotypage afin de distinguer l'analyse dans différents sous-ensembles cellulaires. Cette plateforme utilise des anticorps marqués par fluorescence qui reconnaissent les protéines uniquement lorsqu'elles sont phosphorylés sur des résidus d'acides aminés spécifiques qui régulent leur fonction. Les données de la cytommétrie en flux phospho-flow sont très cohérentes et reproductibles, ce qui crée une plateforme unique pour l'analyse de la signalisation cellulaire.

